近日,我校药学院师生与上海大学、韩国高丽大学合作,在国际顶级学术期刊Angewandte Chemie(中科院一区Top,IF=16.1)发表题为"EngineeringaMultifunctionalNanozymePlatformforSynergisticMelanomaTherapy:IntegratingEnzymeActivity,ImmuneActivation,andLow-TemperaturePhotothermalEffects"的研究性论文。研究生丁启航、刘豪威为论文的共同第一作者,上海大学陈雨教授,高丽大学JongSeungKim院士、成都大学特聘副研究员梅凌为该论文的通讯作者,成都大学为该成果的第一单位。

黑色素瘤具有生长迅速、侵袭性强等特征,导致其恶性程度极高,并具有显著的转移倾向。当前常用的治疗手段,如化疗和放疗,因其严重的副作用及免疫抑制作用,治疗效果有限。因此,开发精准且高效的综合治疗策略显得尤为重要。在此,我们构建了一种具有多功能和多酶活性的碗状纳米系统(FeCP@PDA-GOx),实现了饥饿疗法、化学动力学疗法、温和光热疗法(mPTT)与免疫疗法的协同整合,旨在达成多维度的治疗效果。该纳米平台利用葡萄糖氧化酶(GOx)、过氧化物酶(POD)、氧化酶(OXD)和过氧化氢酶(CAT)等多种酶的催化活性。CAT样活性生成的O₂在碗状纳米粒子开口处积聚,产生推进力,纳米粒子追踪分析(NTA)显示FeCP@PDA-GOx在37°C的葡萄糖溶液中表现出显著的运动性,这不仅增加了纳米粒的细胞摄取,肿瘤球摄取,同时促进溶酶体逃逸作用。通过transwell模型,上层为肿瘤细胞或内皮细胞,来检测下层肿瘤细胞的摄取,模拟从血管渗入肿瘤和肿瘤细胞间的穿透能力。并在小鼠肿瘤模型上显示出增强的蓄积和渗透。
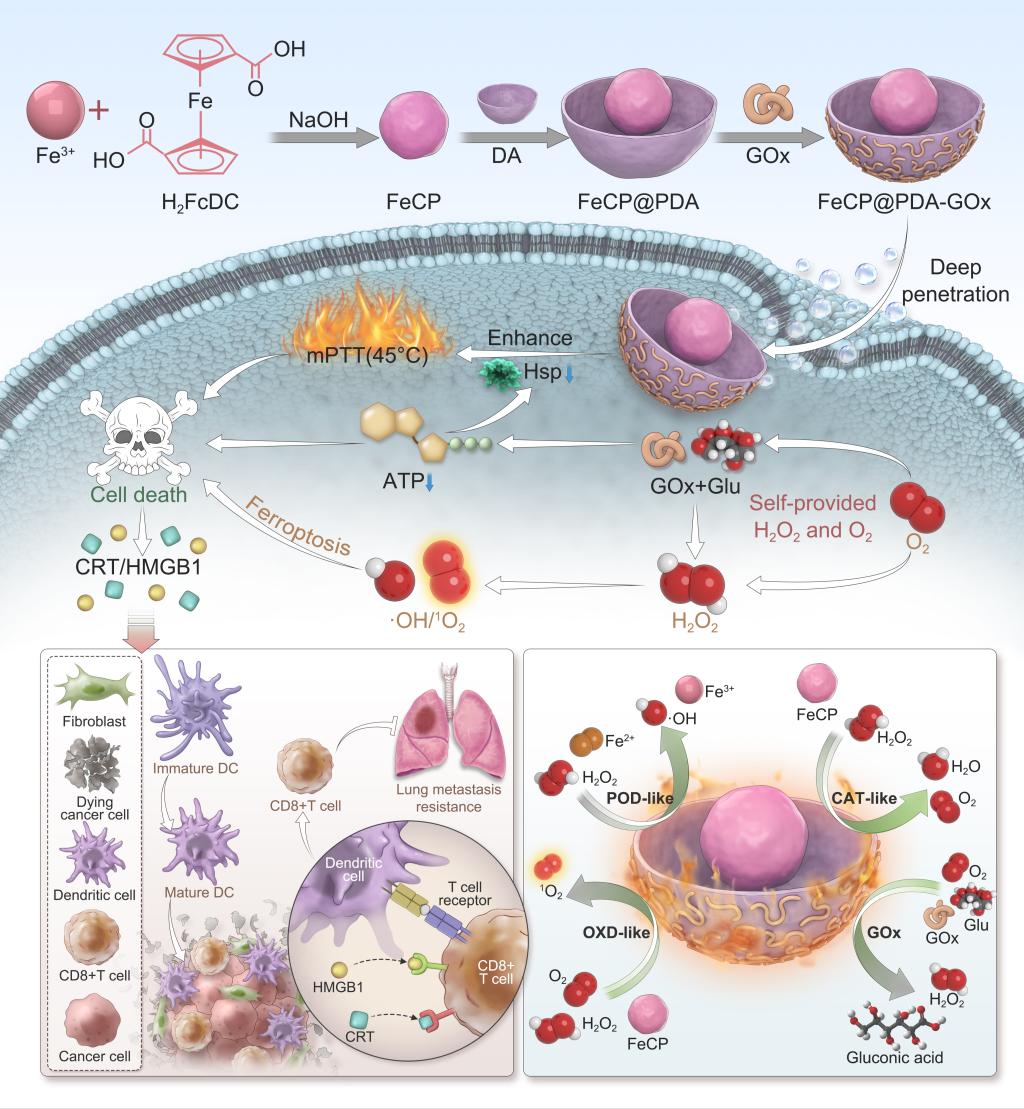
该纳米平台阻断了肿瘤细胞的能量供应,显著抑制肿瘤细胞中热休克蛋白的表达,从而增强温和光热治疗效果。此外,POD活性产生的ROS诱导了细胞的氧化应激反应,诱导了细胞中物堆积,线粒体结构嵴减少、膜收缩和外膜破裂,引起导致的细胞铁死亡。更重要的是,该系统可激发强烈的免疫应答,有效抑制肺部转移,并诱导系统性抗肿瘤免疫效应,从而抑制远端肿瘤的生长。实验结果表明,该多功能纳米平台在黑色素瘤治疗中展现出卓越的疗效与良好的生物安全性,为个体化医疗与智能化治疗策略的进一步发展奠定了坚实基础。
Angewandte Chemie(德国应用化学,OnlineISSN:1521-3773)是Wiley-VCH旗下著名的旗舰刊物之一,中科院1区top期刊,最新影响因子16.1。该期刊涵盖化学综合领域,包括但不限于有机化学、无机化学、材料化学等。特别关注化学领域的前沿研究和跨学科交叉研究,在药剂学领域,该期刊发表的纳米技术、材料科学等相关的研究成果,为药物递送系统的设计和优化提供了新的思路和方法。


 EN
EN 搜索
搜索


